这是演示店铺,请务下单付款,避免造成你的财物损失。
抗体同种型对照
什么是同型对照?
同型对照是一种看起来像常规抗体的抗体,但它不像您通常的一抗那样与特定靶标结合。
同型对照抗体具有(或至少应该具有)与实验中使用的一抗相同的免疫球蛋白和亚类,但缺乏对目标蛋白质的特异性。
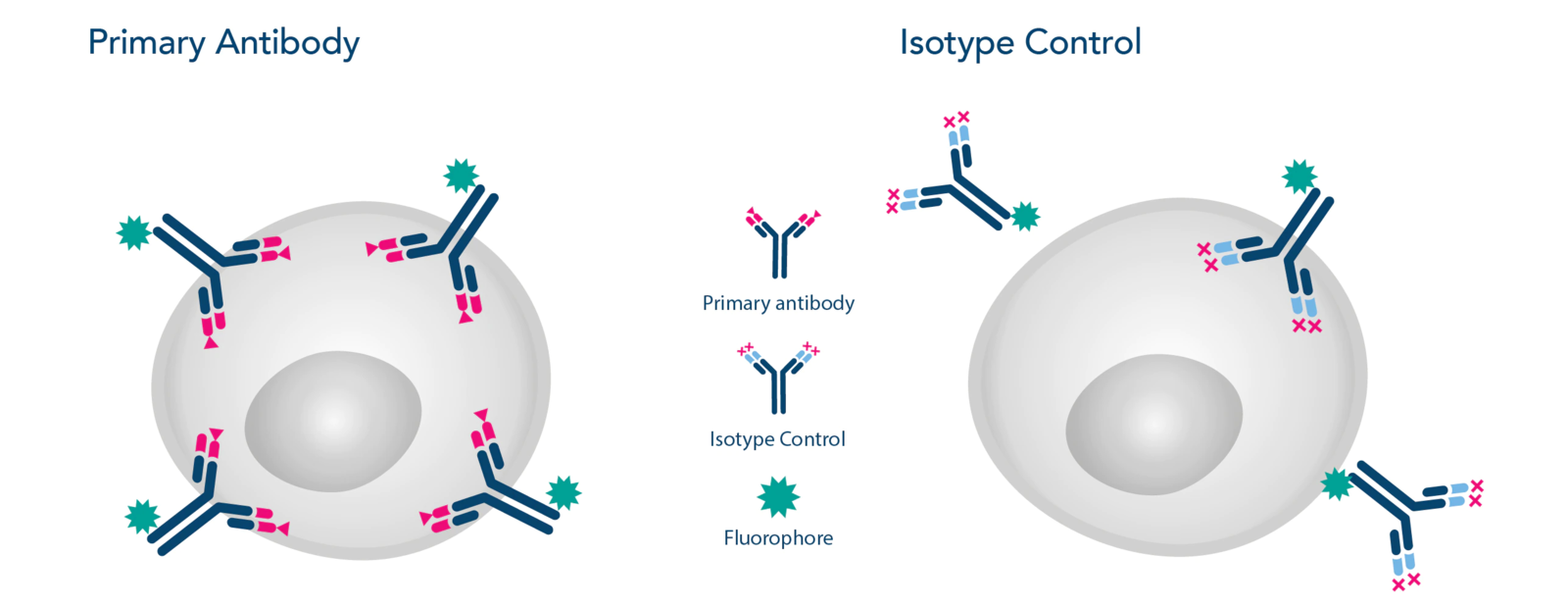
图1:一抗与同型对照。
为什么要使用同型对照?
原因就在名字中:它是一个控件。同型对照是在抗体染色应用中用作阴性对照的抗体。它们使您能够区分实验中的特异性抗体染色和背景染色。
出现背景染色的原因有多种,其中之一是Fc受体相互作用。虽然焦点通常集中在发生有用的靶标特异性结合的Fab区域,但Fc区域也可以被结合。抗体(优势还有其缀合物)可以非特异性结合其他蛋白质、内源酶、脂质和Fc受体。这是因为您会在一系列您不感兴趣的细胞、蛋白质和脂质上发现Fc受体。
同型对照是一种特殊类型的阴性对照,其特征是与实际实验中使用的抗体具有相同的Fc区,但在实验中不应结合抗原的可变区。Fc区可以与Fc受体或补体特异性相互作用;因此,在细胞表面标记物染色时有必要控制这种“背景”。这些相互作用甚至可能是跨物种的;例如,大鼠IgG与小鼠Fc受体。因此,在进行流式细胞术时,传统上需要多种同型对照。
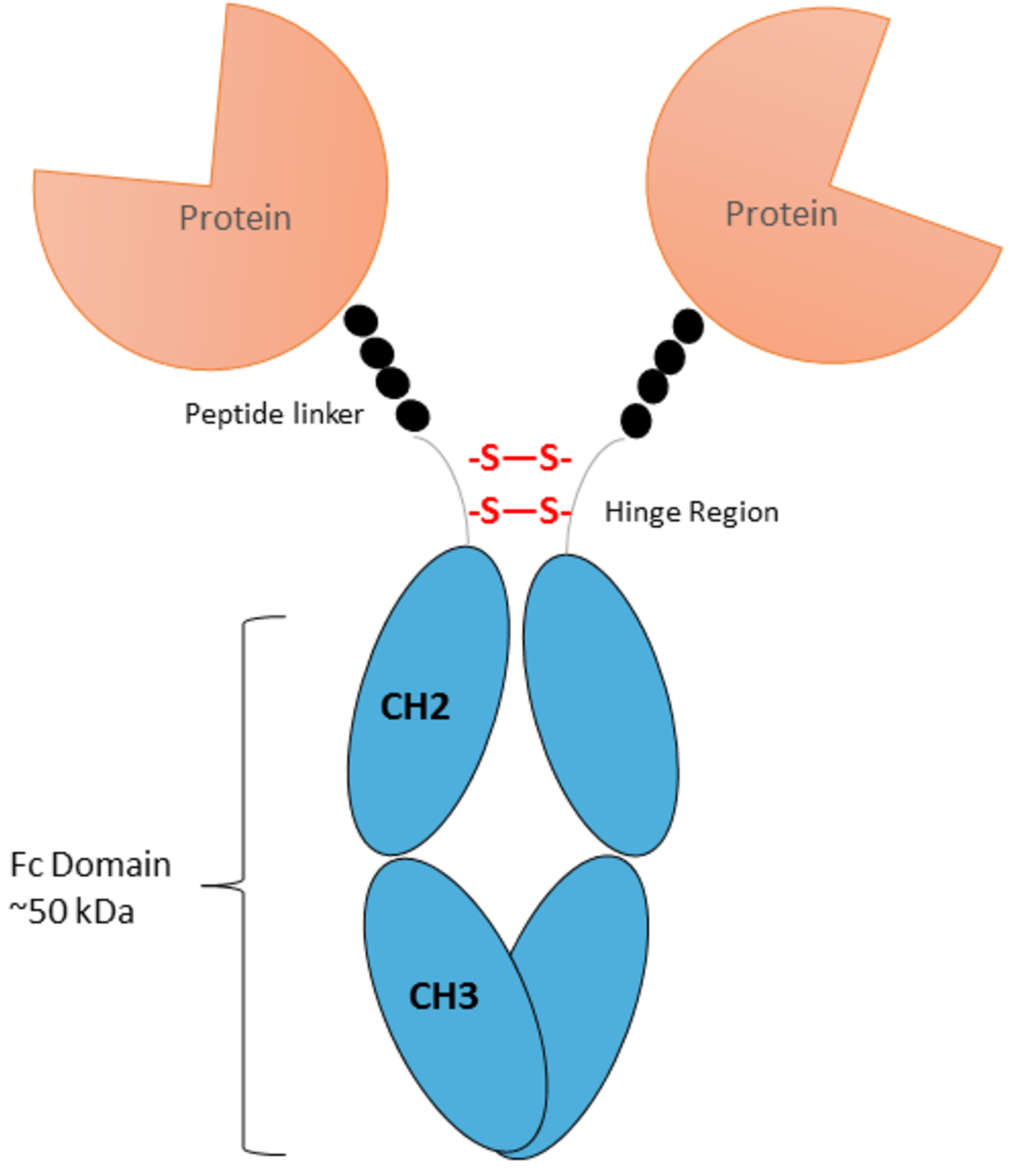
图2:具有Fc结构域的抗体方案。
使用同型对照的优点
通过与主要实验仪器运行对照试验,使用同型对照代替常用的一抗,并确保所有其他条件相同(浓度、缓冲液、温度),您可以确定非特异性背景的程度(即,建立未染色样品的阈值)。
在实验中加入同型对照作为阴性对照,可以让您确定实验方案中的封闭和/或清洗步骤是否足够。
为了证明蛋白质印迹上特定条带的识别或是同抗体在流式细胞术中对细胞表面标记物的染色时特异性的,可以使用阴性对照,该阴性对照不应产生相似的条带图案或染色。
对于流式细胞术,您可能已经运行了“荧光减一”(FMO)对照,其中像往常一样包括了除要建立阈值的试剂之外的所有内容。只要同种型对照具有与您的实验抗体相同的非特异性结合能力,同种型对照就是一个很好的选择。
当读数时表型变化时,这种类型的对照对于包括体内或体外阻断/中和/消耗/激活实验尤其重要。
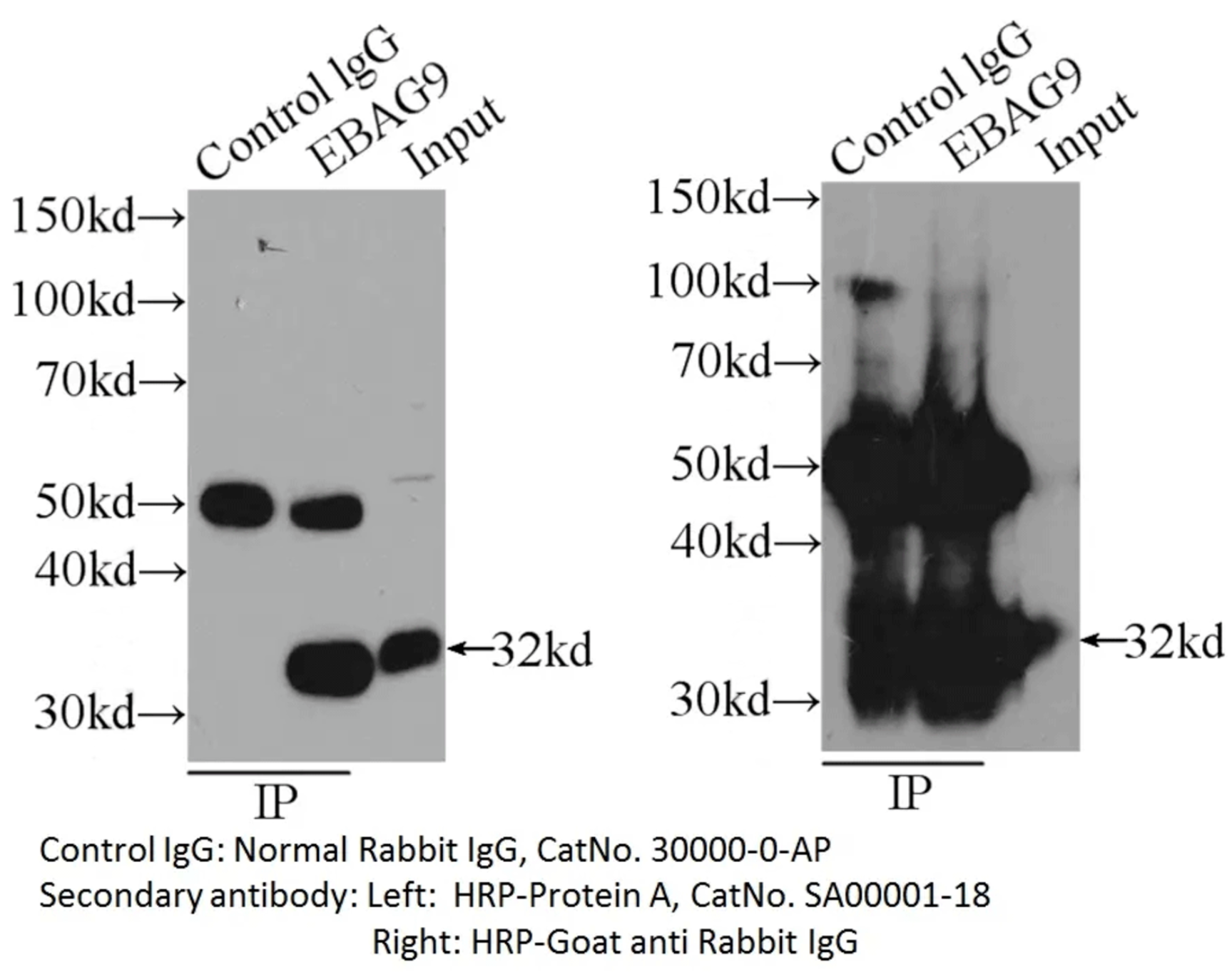
图3:使用不同二抗检测的IP样品。正常兔IgG(30000-0-AP)作为对照。
如何选择最佳的同型对照?
同型对照应与您的一抗的某些特征相匹配:
同一宿主物种
相同的Ig类型
相同的Ig亚型(对于某些物种)
与一抗相同的标签(生物素、HRP、荧光团等)
例如,如果您使用的一抗是与FITC偶联的小鼠IgG2b抗体,则您需要选择也与FITC偶联的小鼠IgG2b同型对照抗体。
如果您使用为偶联的一抗和二抗进行检测,您的同种型对照应与您的一抗相匹配,以确定一抗的非特异性结合。仅二抗对照(仅用二抗染色的样品;不使用一抗)可作为对照,以确定二抗的任何背景染色。
图4:提供的标准化对照。
新的FITC共轭同型对照
重要的是对照试剂应尽可能接近您使用的实验抗体。一旦有了可用的试剂,同型对照就会与多种实验抗体一起在多种细胞类型(J774、BV-2、Jurkat、THP-1和TK-1)和物种(小鼠和人类)中进行测试。由于流式细胞术可能是这些试剂的重点,因此通过对活细胞上的细胞表面蛋白进行染色并通过流式细胞术进行分析来验证它们。
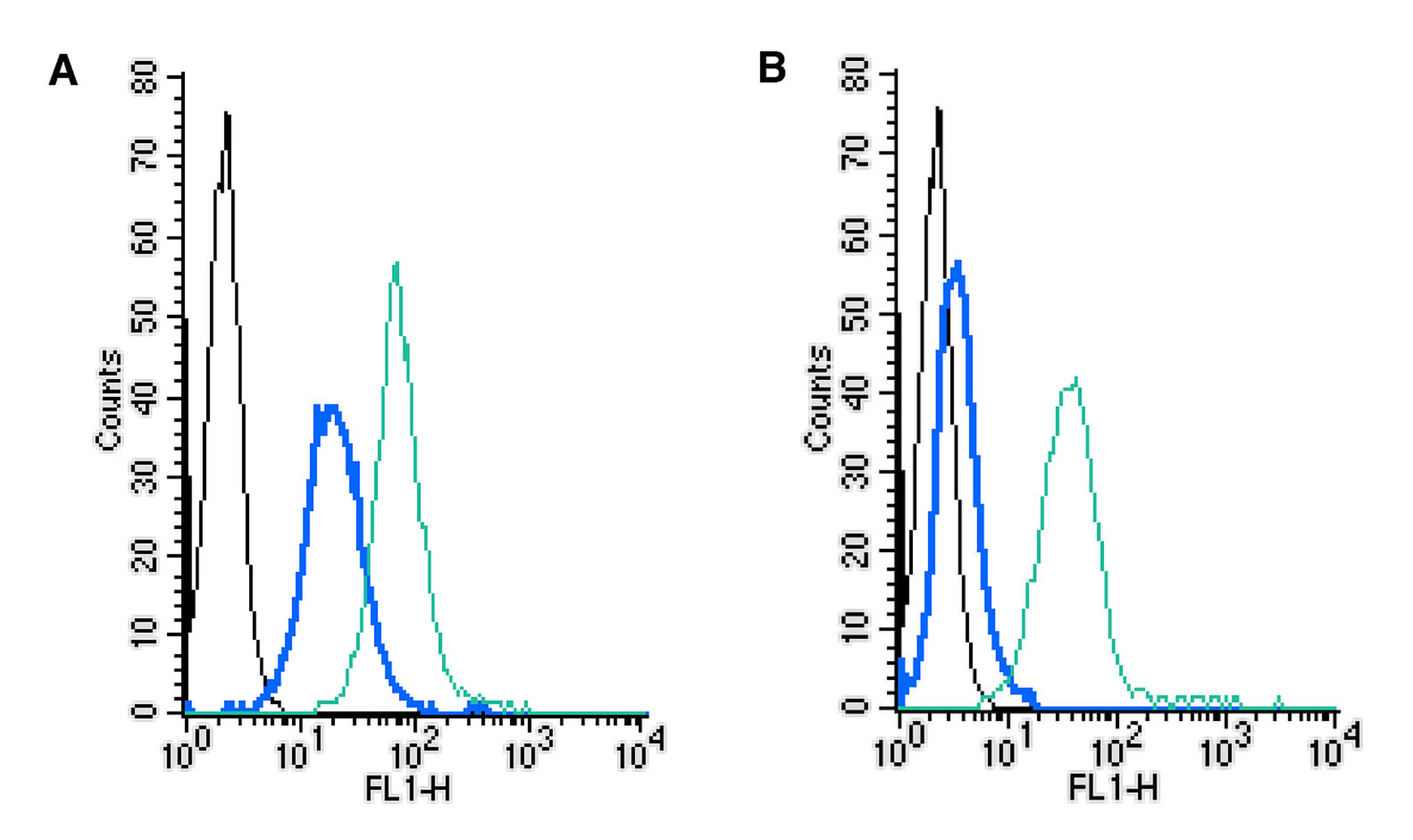
图 5: 通过直接流式细胞术在活的完整小鼠J774巨噬细胞系中确定兔IgG同型对照-FITC对照以及MERTK细胞表面检测的有效性。(A)缺少Fc区域。(B)Fc区域存在。黑色:未染色的细胞。蓝色: 细胞+兔IgG同型对照-FITC。 绿色:细胞+抗MERTK(细胞外)-FITC抗体。
参考文献
1 Maecker, H.T., Trotter, J., 2006. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry Part A 69, 1037–1042.
2 Perfetto, S.P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M., 2006. Quality assurance for polychromatic flow cytometry. Nat Protoc 1, 1522–1530.
3 Cossarizza, A., Chang, H. D., Radbruch, A., Acs, A., Adam, D., Adam-Klages, S., ... & Bacher, P. (2019). Guidelines for the use of flow cytometry and cell sorting in immunological studies. European journal of immunology, 49(10), 1457-1973.
4 Roederer, M., Nozzi, J. L., & Nason, M. C. (2011). SPICE: exploration and analysis of post-cytometric complex multivariate datasets. Cytometry Part A, 79(2), 167-174.
 首页
首页 400-620-6333
400-620-6333



 危险品化学品经营许可证(带存储)
危险品化学品经营许可证(带存储)